Para saber qué es la química y cómo está organizada hay que empezar por la parte más pequeña, por decirlo de otra manera, hay que empezar por los ladrillos para construir la casa. Estos ladrillos son los átomos. Como veremos a continuación, estos átomos están compuestos de partículas más pequeñas que serán importantes en algunos casos. Empezamos!!
¿De dónde vienen los átomos?
La teoría atómica no es algo que provenga del siglo XIX o XX, si no que se propuso allá por el siglo V o VI a.C., con Demócrito como principal autor de esta teoría. Defiende que toda la materia no es más que una mezcla de elementos originarios que poseen las características de inmutabilidad y eternidad, concebidos como entidades infinitamente pequeñas y, por tanto, imperceptibles para los sentidos, a las que Demócrito llamó átomos, término griego que significa indivisible, que no puede dividirse en tomos, como las enciclopedias (a-tomo). Esta teoría fue perdiendo importancia a favor de otras como la de los 4 elementos naturales (fuego, agua, aire y tierra) o el creacionismo.
Modelo de Dalton
No fue hasta el siglo XVIII donde científicos como Lavoisier o Proust (que desarrolló buena parte de sus investigaciones en España, en concreto en el Alcázar de Segovia) empezaron a observar que las sustancias se combinaban y se comportaban como si estuviesen hechas de partículas diferentes más pequeñas. Basado en estos descubrimientos y otros realizados por él mismo, Dalton creó una lista con pesos atómicos de cada uno de los átomos, asignándoles masas relacionadas con respecto al más ligero, al hidrógeno. Todos estos científicos entendieron los átomos como entes indivisibles.Modelo de Thomson
No fue hasta 1897 cuando Thomson observó en un tubo a vacío que, al aplicar un voltaje entre dos electrodos separados se observaba que el tubo se iluminaba por el lado del ánodo (polo positivo).  |
| Tubo de rayos catódicos De Zátonyi Sándor, (ifj.) - Trabajo propio, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=10345950 |
Debido a que estos rayos procedían del cátodo se les llamó rayos catódicos (tampoco se lo pensaron mucho). Se observó que estos rayos eran desviados por campos magnéticos, siendo repelido por el polo negativo y atraído por el positivo, por lo que se le asignó carga negativa. Posteriormente, se probó que estos rayos podían mover un pequeño molinete colocado dentro del tubo de vacío, por lo que se empezaron a considerar como corpúsculos, su nombre original, que fue modificado posteriormente a electrón.
Debido a que los electrones no eran átomos, significaba que tenían que ser una parte de los átomos, es decir, dejaba de ser indivisible. Thomson propuso que, ya que los electrones se desprendían del átomo y tenían carga negativa, éste debería ser una bola cargada positivamente en cuya superficie se encontrarían estos electrones, dando lugar al Modelo atómico de Thomson o vulgarmente conocido como el modelo del pastel de pasas (para que os hagáis una idea, como un Doowap o Weikis).
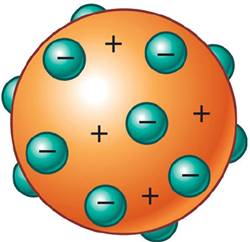 |
| Modelo atómico de Thomson (https://quimica.laguia2000.com/general/modelo-atomico-de-thomson) |
Modelo de Rutherford
Tras este modelo, un discípulo de Thomson apellidado Rutherford trató de averiguar cómo de grandes eran esas esferas con carga positiva. Para ello, empleó partículas alfa (cargadas positivamente, para que se repeliesen) y las disparó contra una delgada lámina (unos pocos átomos de espesor) de oro, detectando cómo se desviaban mediante una pantalla fluorescente. |
| Experimento de Rutherford (http://www.rolscience.net/2016/08/experimento-de-rutherford.html) |
Se observó que un gran número de las partículas lanzadas se desviaba ligeramente, pero algunas sufrieron desviaciones grandes y, lo más importante, un pequeño número de partículas rebotó hacia atrás. Esto, para la idea que se tenía acerca del átomo, era tan impresionante e imprevisible que, en palabras del propio Rutherford, era igual a si se disparaba una bala de cañón contra una hoja de papel y esta rebotase.
Por todo esto, propuso un nuevo modelo en el que el átomo estaba vacío, toda la carga positiva se concentraba en el centro (o núcleo), haciendo que rebotasen estas partículas, mientras que los electrones se movían libres alrededor, dando lugar al Modelo atómico de Rutherford (el que se ve siempre, vamos).
 |
| Modelo atómico de Rutherford (http://gifimage.net/modelo-atomico-de-rutherford-gif/) |
En 1913, Thomson (el de antes) canalizó una corriente de iones de neón a través de campos magnéticos y eléctricos, hasta chocar con una placa fotográfica que había colocado al otro lado. Observó dos manchas en la placa, que revelaban dos trayectorias de desviación diferentes. Thomson concluyó que esto era porque algunos de los iones de neón tenían diferentes masas. Debido a que son especies del mismo elemento (aunque tienen distinta masa) se las denominó isótopos (iso-topo), que quiere decir que están en el mismo lugar (de la tabla periódica).
| Isótopos de Ne por Thomson |
En 1918, Rutherford descubrió que cuando se disparan partículas alfa contra un gas de nitrógeno, sus detectores de centelleo mostraban señales de núcleos de hidrógeno. Determinó que el único sitio del cual podían provenir estos núcleos era del nitrógeno y que el nitrógeno debía contener núcleos de hidrógeno. Por estas razones, Rutherford sugirió que el núcleo de hidrógeno, del que en la época se sabía que su número atómico era 1, debía ser una partícula fundamental. Lo denominó protón, el primero, ya que tenía masa 1, siendo 1836 veces más grande que el electrón.
Posteriormente, en 1928, Bothe descubrió que al bombardear átomos de berilio con partículas alfa se emitían partículas sin carga. Los posteriores experimentos de Chadwick demostraron que esas partículas eran eléctricamente neutras y de una masa similar a la del protón. Como era neutro, lo llamaron neutrón (tampoco se complicaron con este). Por tanto, en la modificación del modelo de Rutherford, se introdujo que el núcleo no era una esfera positiva, si no que estaba compuesto de dos partículas más pequeñas, los protones (con carga positiva) y los neutrones (sin carga, sólo aportan masa).
Hubo que esperar unos años, hasta que Planck y Einstein desarrollaron la teoría cuántica, para que Bohr postulase que los electrones no se podían mover libremente, únicamente a distancias fijas del núcleo. Con esto se explicaba por qué los electrones no se iban al núcleo y por qué los espectros de emisión eran líneas discretas y no un espectro continuo (las líneas corresponden a la diferencia de energía entre las distancias de los niveles). Llegamos al modelo atómico de Bohr, mucho más complejo que el de sus predecesores debido a que no estaba basado en la observación, si no en cálculos y teorías matemáticas bastante complejas. Esa fue la principal razón de que, a partir de aquí, se perdiese el interés de mucha gente y el modelo atómico general sea todavía el de Rutherford.
Demasiado complicado y abstracto para muchos.
Hasta aquí el (tostón del) proceso de averiguar cómo se ha construido el átomo. Todo lo que es el núcleo y los electrones, de momento, no se han podido ver aunque mediante técnicas como el microscopio de fuerza atómica (AFM) y el de efecto túnel (STM) si que se ha podido ver la envoltura electrónica de los átomos.
Nos vemos la semana que viene con más, y espero que mejor, ciencia. Si hay alguna duda, sugerencia o queréis que amplíe más algún tema (por ejemplo, por qué si los protones están cargados positivamente no se repelen en el núcleo) podéis dejarlo en los comentarios de aquí abajo⇓. No os olvidéis de suscribiros para enteraros de todo
Cuidaos y nos vemos en el próximo post!!
Modelo de Bohr
Este modelo explicaba el comportamiento de los átomos así como su clasificación y sus isótopos, pero si los electrones tienen carga negativa y los protones positiva... ¿por qué los electrones no se van al núcleo en vez de quedarse dando vueltas? Otra pregunta sin respuesta en aquel momento era por qué los átomos sólo pueden emitir (o absorber) luz sólo de determinados colores. |
| Espectros de emisión atómica (https://triplenlace.com/2013/01/01/espectro-continuo-de-emision-y-de-absorcion/) |
Hubo que esperar unos años, hasta que Planck y Einstein desarrollaron la teoría cuántica, para que Bohr postulase que los electrones no se podían mover libremente, únicamente a distancias fijas del núcleo. Con esto se explicaba por qué los electrones no se iban al núcleo y por qué los espectros de emisión eran líneas discretas y no un espectro continuo (las líneas corresponden a la diferencia de energía entre las distancias de los niveles). Llegamos al modelo atómico de Bohr, mucho más complejo que el de sus predecesores debido a que no estaba basado en la observación, si no en cálculos y teorías matemáticas bastante complejas. Esa fue la principal razón de que, a partir de aquí, se perdiese el interés de mucha gente y el modelo atómico general sea todavía el de Rutherford.
 |
| Modelo atómico de Bohr (https://www.timetoast.com/timelines/la-historia-del-modelo-atomico) |
Modelo mecano-cuántico
El modelo mecano-cuántico (y el empleado actualmente) está basado en el desarrollo posterior de la mecánica cuántica y de la espectroscopía (medida de los espectros), en el que los niveles de Bohr se cambian por funciones de probabilidad de encontrar a un electrón en un determinado volumen, dando lugar a los orbitales atómicos. Todo esto está basado en la dualidad onda-corpúsculo de De Broglie, que demostró que toda partícula se puede comportar como una onda, por tanto, los electrones se podían modelizar por ondas. Con esta idea, Schrödinger definió una ecuación para el comportamiento de los electrones en las órbitas atómicas, la famosa ecuación de Schrödinger. Con el cuadrado de esta ecuación se obtiene la probabilidad de encontrar al electrón en un volumen determinado, convirtiendo al electrón en una densidad de probabilidad.Demasiado complicado y abstracto para muchos.
Hasta aquí el (tostón del) proceso de averiguar cómo se ha construido el átomo. Todo lo que es el núcleo y los electrones, de momento, no se han podido ver aunque mediante técnicas como el microscopio de fuerza atómica (AFM) y el de efecto túnel (STM) si que se ha podido ver la envoltura electrónica de los átomos.
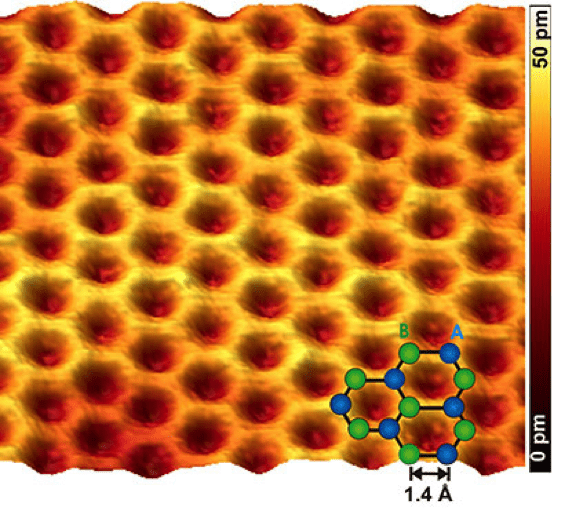 |
| Imágen de grafeno mediante AFM (https://www.zmescience.com/science/physics/smallest-atomic-force-microscope/) |
Cuidaos y nos vemos en el próximo post!!

No hay comentarios:
Publicar un comentario