Hoy me propongo indagar en las características y propiedades de la tabla periódica, probablemente una de las imágenes más reconocibles de la química. Empezamos!!
¿Qué es la tabla periódica?
| Tabla periódica de los elementos |
El orden de la tabla periódica sigue un criterio de propiedades y estados electrónicos comunes, es decir, los elementos en la misma columna tienen propiedades comunes como, por ejemplo, los estados de oxidación mientras que, en la misma fila comparten masas comunes y energías parecidas.
En esta tabla periódica se observa que en la misma columna suelen coincidir muchos estados de oxidación. Esto es debido a que, en la misma columna, el número de electrones y su organización es igual (aunque no su energía). Debido a que la carga del núcleo (número de protones) no es constante, si no que varía poco a poco, hace que la fuerza de atracción de estos electrones varíe poco a poco. Esto supone que otras propiedades asociadas, como el radio atómico, energías de ionización o electronegatividad, varíen de manera periódica a través del diagrama dependiendo de la carga nuclear que "vean".
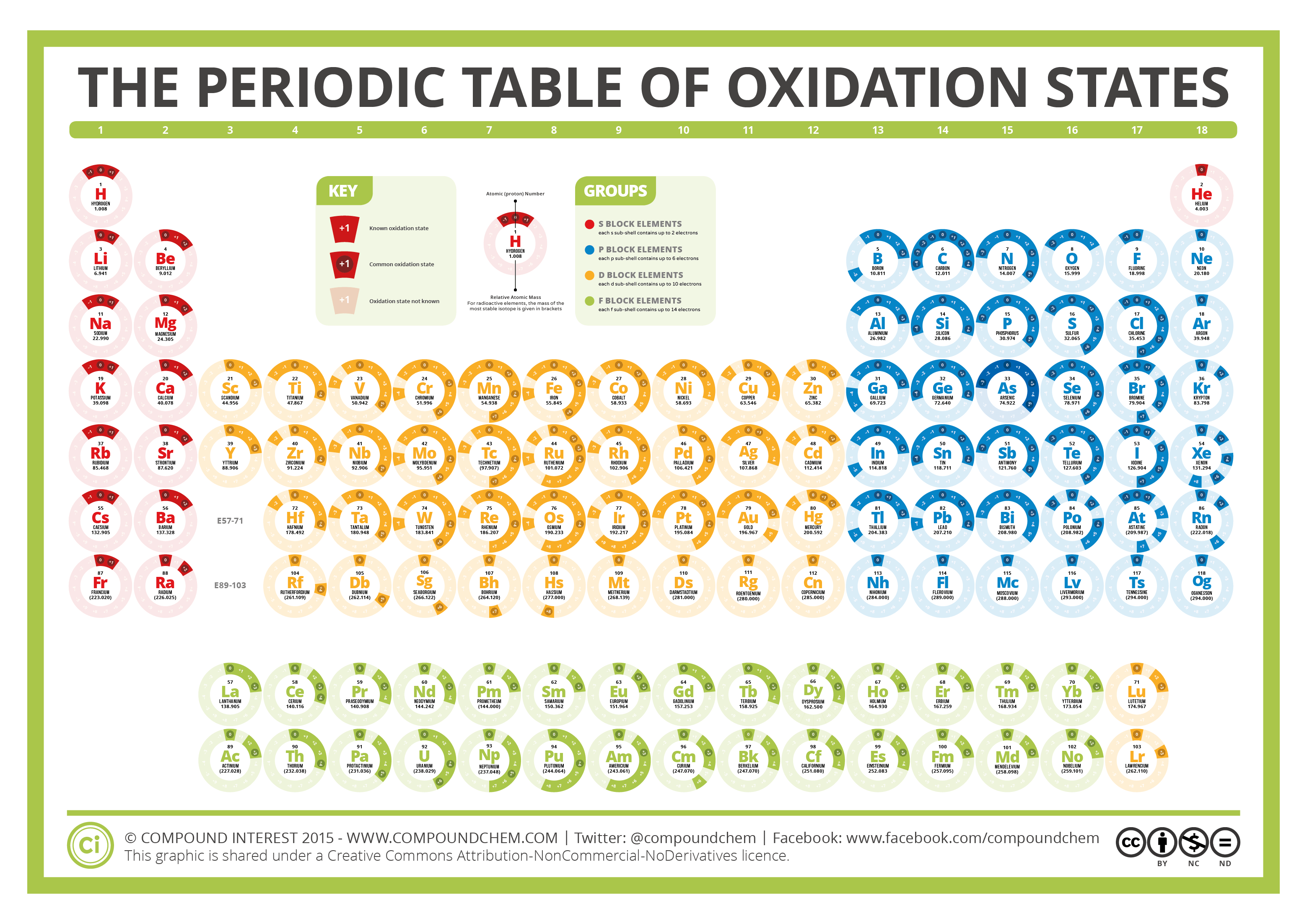 |
| Tabla periódica de los estados de oxidación http://www.compoundchem.com/2015/11/17/oxidation-states/ |
 |
| Periodicidad en la tabla periódica, valga la redundancia http://www.compoundchem.com/2014/02/12/periodicity-trends-in-the-periodic-table/ |
¿Por qué tiene esa forma?
La forma de la tabla periódica es una representación gráfica de ordenar los elementos, es un artificio para entendernos todos. Esta ordenación responde bastante bien a la ordenación del llenado de los orbitales por los electrones que, al fin y al cabo, son quienes proporcionan la mayoría de las propiedades.
Como muchos recordareis de vuestra época de secundaria y del blog del átomo (modelo de Bohr), existen diferentes niveles de energía donde se puede colocar un electrón, siendo el nivel 1 el más bajo y creciendo según crece la energía (recuerda que la energía no es continua si no que son pisos en un edificio, cada número es un piso). Posteriormente, estos pisos se dividieron en escalones, teniendo cada piso tantos escalones como el número del piso, es decir, cada nivel electrónico tiene tantos niveles magnéticos como su número de nivel (entra dentro de la teoría de Bohr pero se explotó mayoritariamente en la teoría mecano-cuántica). Los niveles magnéticos se denominaron con letras (s, p, d, f...) dependiendo de su forma.
 |
| Forma de los orbitales http://tetracuties.blogspot.com.es/2011/04/electronic-structure-of-atom.html |
Además de variar en la forma, cuanto más sencillos son menos energía tienen, de manera que dentro de un nivel se llenarán antes los niveles s que los p, y éstos antes que los d, ya que son más estables. Este hecho hace que en niveles altos la energía de un nivel s superior pueda ser más baja que, por ejemplo un nivel d o f inferior. El orden de energía, y por tanto de llenado de los orbitales (aunque hay excepciones), se muestra en los diagramas inferiores.
 |
| Niveles de energía http://quantumnumbers.weebly.com/electron-configuration.html |
| Orden de llenado de orbitales https://chem.libretexts.org/LibreTexts/Mount_Royal_University/Chem_1201/ Unit_2._Periodic_Properties_of_the_Elements/2.02%3A_Electron_Configurations |
Una vez que ya conocemos como se ordenan los niveles, hay que ver cómo se orientan en el espacio. El nivel s es una esfera, por lo que todas las orientaciones son equivalentes, sólo tiene una orientación y un único subnivel. El nivel p tiene 3 posibles orientaciones en el espacio, orientado en el eje x, en el y, y en el z, resultando 3 niveles de igual energía. El nivel d tiene 5 orientaciones en el espacio, resultando 5 subniveles. El nivel f tiene 7 orientaciones y 7 subniveles.
| Forma y nomenclatura de los orbitales https://chem.libretexts.org/Core/Physical_and_Theoretical_Chemistry/Quantum_Mechanics/ 09._The_Hydrogen_Atom/Atomic_Theory/Electrons_in_Atoms/Electronic_Orbitals |
Para acabar de complicar las cosas, en cada subnivel entran 2 electrones, es decir en cada nivel s entran 2 electrones, en cada nivel p entran 6 electrones (3 niveles x 2 electrones) y así sucesivamente.
¿Y que tiene que ver todo este rollo con la tabla periódica?
Pues si nos volvemos a fijar en la tabla periódica, hay varias zonas diferenciadas, llamadas bloques, que corresponden a los orbitales y observándose que el número atómico corresponde al llenado de electrones (salvo excepciones menores).
| Bloques electrónicos en la tabla periódica https://chem.libretexts.org/LibreTexts/University_of_Missouri/UM%3A_Chem_1320_(Keller)/ 06._Electronic_Structure_of_Atoms/6.9%3A_Electron_Configurations_and_the_Periodic_Table |
Hay que comentar que el la tabla anterior los bloques 4f y 5f estarían colocados por orden de llenado entre los bloques 6s-5d y 7s-6d, respectivamente. También llama la atención que el He está colocado fuera del bloque s, ya que sus propiedades no coinciden con su columna "teórica" y se corresponden mejor con las propiedades de los gases nobles. De igual manera hay a veces cierta duda en dónde colocar el H si en el grupo 1 o 17, ya que su comportamiento es bastante singular, pero por convenio está colocado en el grupo 1.
Una vez entendido esto de las configuraciones electrónicas podemos ver que los elementos en la misma columna tienen, efectivamente, los mismos electrones en el último nivel y, por tanto, tienden a perder/atrapar los mismos electrones (valencias).
Nos vemos en el próximo post!!
Cuídate!!
Conclusión
Sin entrar demasiado en detalles, hemos visto que el orden en la tabla periódica y su forma tienen un porqué y cómo se organizan los electrones en el átomo, en un montón de subniveles. Es importante conocer la tabla periódica, qué implica que un elemento esté en una posición concreta. Como muchos dicen, es importante conocer la tabla periódica ya que es como el alfabeto de un químico (aunque realmente no se suelen usar muchos mas de 10 elementos habitualmente).Nos vemos en el próximo post!!
Cuídate!!

No hay comentarios:
Publicar un comentario